Experten für Impfstoffherstellung
Wacker Biotech ist Ihr bevorzugter CDMO-Partner für die Prozessentwicklung und Herstellung einer vielfältigen Palette von Impfstoffen – von lebend, abgeschwächt, inaktiviert und (konjugierten) Polysaccharid-Impfstoffen bis hin zu Protein- und mRNA-basierten Impfstoffen.
Impfstoff-Innovation und Erfahrung

Wacker Biotech blickt auf über 30 Jahre Erfahrung in der Herstellung konventioneller Impfstoffe mithilfe mikrobieller Wirte für verschiedene Infektionskrankheiten zurück. Wir sind stolz darauf, mit unseren Kunden mehrere kommerzielle Programme auf den Markt gebracht zu haben, die weltweit weiterhin Bevölkerungen schützen.
In den letzten Jahren haben wir nach intensiver Forschung die Expertise zur Herstellung von mRNA-basierten Impfstoffen der nächsten Generation entwickelt und ein hochmodernes Kompetenzzentrum in Halle (Deutschland) mit vier neuen dedizierten Produktionslinien für mRNA aufgebaut. Das hochmoderne Zentrum wurde teilweise von der deutschen Regierung im Rahmen des Programms zur Pandemievorsorge gefördert.
Ihre Vorteile
Impfstofftypen
Erfahrung mit verschiedenen Bakterienstämmen
Unsere Stärken
Erfahren Sie mehr über die Herstellung konjugierter Polysaccharid-Impfstoffe
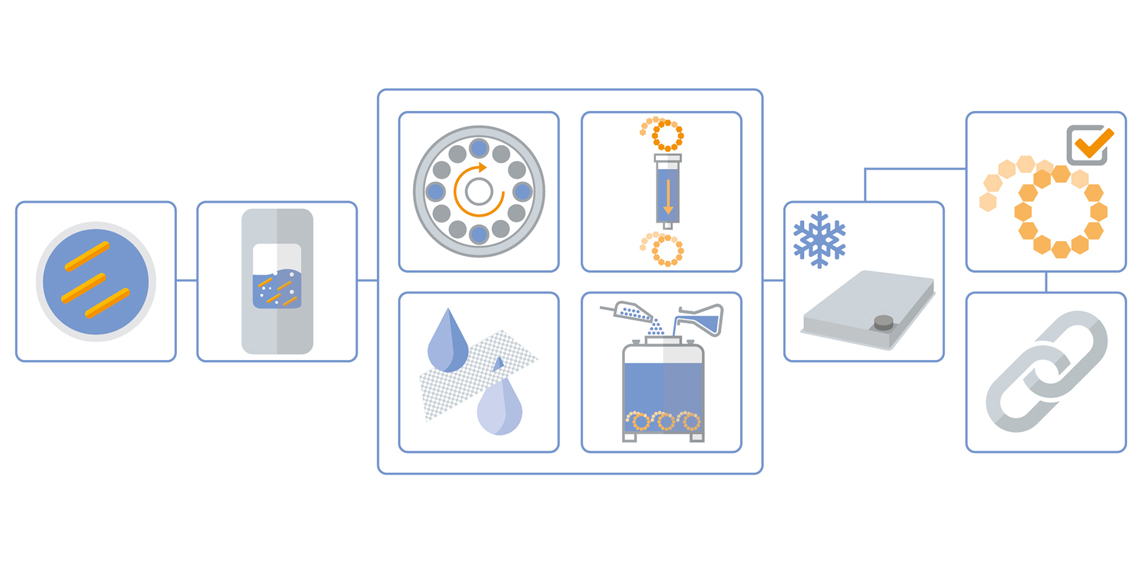
Inokulation & Vorkulturen
Die Stämme für die Produktion der Polysaccharide werden vom Kunden für den ersten Produktionsschritt bereitgestellt.
Fermentation
Durch die Nutzung der von der EMA und FDA zugelassenen Produktionslinien von Wacker Biotech (Fermenterkapazitäten von 250 l Single-Use bis 1.500 l Edelstahlreaktoren) können Kunden den Maßstab der GMP-Prozesse flexibel an die Anforderungen jedes Projekts und jeder Entwicklungsphase anpassen.
Aufreinigung
Die Aufreinigung des Polysaccharids aus der Fermentationsbrühe umfasst in der Regel mehrere Schritte, darunter:
• Zentrifugation des Pathogens nach chemischer/thermischer Inaktivierung
• Konzentration des Zwischenprodukts durch Ultrafiltration und/oder Tiefenfiltration
• Fällung des Polysaccharids mithilfe anorganischer Salze und/oder organischer Lösungsmittel (erfordert explosionsgeschützte Räume und Anlagen)
• Chromatographieschritte
Lyophilisierung
Die Konjugation des gereinigten Polysaccharids an ein Trägerprotein erfolgt durch Dosierung der Polysaccharide in LYOGUARD® -Schalen zur Lyophilisierung. Es werden Lyophilisierungsläufe von bis zu 65 l unterstützt.
Aktivierung
Die lyophilisierten Polysaccharide in Großmengen werden durch einen chemischen Aktivierungsschritt aktiviert.
Konjugation
Im letzten Schritt werden die aktivierten Polysaccharide chemisch an das Trägerprotein bzw. die Trägerproteine konjugiert.
Referenzen
Vaxchora® für PaxVax
An unserem Standort in Amsterdam haben wir Vaxchora®hergestellt, einen abgeschwächten Lebendimpfstoff gegen Cholera zum Einnehmen für den kommerziellen Markt für unseren Kunden PaxVax (mittlerweile von Emergent BioSolutions übernommen). Orale Impfstoffe sind heute der Standard zur Vorbeugung gegen Cholera, nachdem injizierbare Impfstoffe in den 1970er Jahren eingestellt wurden, als festgestellt wurde, dass sie zu viele Nebenwirkungen verursachen.
Vaxchora® wurde 2016 von der FDA zugelassen und ist für Personen im Alter von 2 bis 64 Jahren bestimmt, die in ein Gebiet reisen, in dem die Krankheit endemisch ist. Es ist der einzige in den Vereinigten Staaten zugelassene Cholera-Impfstoff und wurde auch von der Europäischen Arzneimittelagentur (EMA) zugelassen.
Vibrio cholerae ist eine Art gramnegativer, fakultativ anaerober Bakterien, die häufig zu starkem und tödlichem Durchfall und Erbrechen führen. Unsere hochmodernen Einrichtungen waren ideal, um die Fermentation dieses Bakteriums in einer monoseptischen Umgebung der Biosicherheitsstufe 2 durchzuführen.
GBS-Impfstoff für MinervaX
Das dänische Unternehmen MinervaX hat kürzlich auf den Aufruf der Weltgesundheitsorganisation reagiert, einen Impfstoff gegen Streptokokken der Gruppe B (GBS) zu entwickeln, ein Bakterium, das bei Säuglingen, Schwangeren und älteren/gefährdeten Erwachsenen lebensbedrohliche Infektionen verursachen kann. Es wird mit einer halben Million Frühgeburten pro Jahr in Verbindung gebracht. Ein Impfstoff würde nicht nur Leben retten, sondern auch den übermäßigen Einsatz von Antibiotika verringern, der zu Antibiotikaresistenzen führen kann.
Der führende Impfstoffkandidat von MinervaX, der aus Forschungen an der Universität Lund hervorgegangen ist, ist ein neuartiger Impfstoff, der ausschließlich aus Proteinen besteht und auf Fusionen hoch immunogener und proaktiver Proteindomänen aus ausgewählten Oberflächenproteinen von GBS basiert. Wacker Biotech wird den aktiven Proteingehalt für die klinischen Phase-III-Studien herstellen. Unser Impfstoff-Kompetenzzentrum in Amsterdam wird auch den Technologietransfer, die Prozesscharakterisierung und die Prozessvalidierung für die spätere kommerzielle Herstellung übernehmen.
"Wacker Biotech ist ein zuverlässiger Produktionspartner mit einer beeindruckenden Erfolgsbilanz bei Projekten in der späten klinischen und kommerziellen Phase, und wir freuen uns auf die Zusammenarbeit im Vorfeld der Phase III-Studien."
Weitere Infos finden Sie hier
Brochures
Links
MinervaX und Wacker Biotech kündigen eine Produktionskooperation für einen prophylaktischen Impfstoff gegen Gruppe-B-Streptokokken an, 14. September 2024
Link ansehenPandemievorsorge: WACKER und CordenPharma werden bei Bedarf mRNA-Impfstoffe für Deutschland produzieren, 11. April 2022
Link ansehenCureVac und WACKER unterzeichnen Herstellungsvertrag für den COVID-19-Impfstoffkandidaten von CureVac: CVnCoV, 23. November 2020
Link ansehenBesser mit WACKER
Wir freuen uns darauf, Ihre Biologika zum Leben zu erwecken.