Inokulation & Vorkulturen
Die Stämme werden vom Kunden bereitgestellt.
Seit mehr als 18 Jahren ist Wacker Biotech ein Pionier in der Entwicklung und Herstellung mikrobieller Produkte (LMP). Unser Standort in Amsterdam beherbergt unser LMP-Kompetenzzentrum mit umfassender Expertise in der Produktion von Arzneimitteln, die lebende Mikroben enthalten, darunter injektierbare Immuntherapien, topische Medikamente und abgeschwächte Lebendimpfstoffe.
Kontakt
Kunden profitieren von einer breiten Palette an GMP-Skalen, die den Anforderungen jedes Projekts und jeder Entwicklungsphase entsprechen. Wir bieten von EMA/FDA zugelassene Produktionslinien von 250 l Einweg-Bioreaktoren bis zu 1.500 l Edelstahltanks.
Sie profitieren zudem von unserer einzigartigen LIBATEC® -Plattform in Kombination mit unserer umfassenden Erfahrung mit einer Vielzahl von Bakterien, darunter Wildtyp-, gentechnisch veränderte, aerobe und anaerobe Stämme. Diese Bakterien können für ein breites Spektrum von LMPs eingesetzt werden, einschließlich der von der FDA definierten Klasse der Live Biotherapeutic Products.
Mehr über LIBATEC® erfahren
| Erfahrung und Expertise mit über 20 verschiedenen Stämmen | |||
|---|---|---|---|
| Aerotolerant | |||
Gram-negativ |
|
|
Gram-positiv |
|
|
||
| Aerointolerant | |||
Die proprietäre LIBATEC® (Li ve Ba cterial Tec hnology) Plattform von Wacker Biotech ermöglicht eine Herstellung ohne Wartezeiten – eine entscheidende Voraussetzung beim Arbeiten mit lebenden Organismen – und gewährleistet die Zellvitalität während des gesamten Produktionsprozesses. Die Plattform eignet sich zudem hervorragend für eine Vielzahl lebender mikrobieller Stämme und Fermentationsregime, sowohl für aerobe als auch für bestimmte anaerobe Organismen.
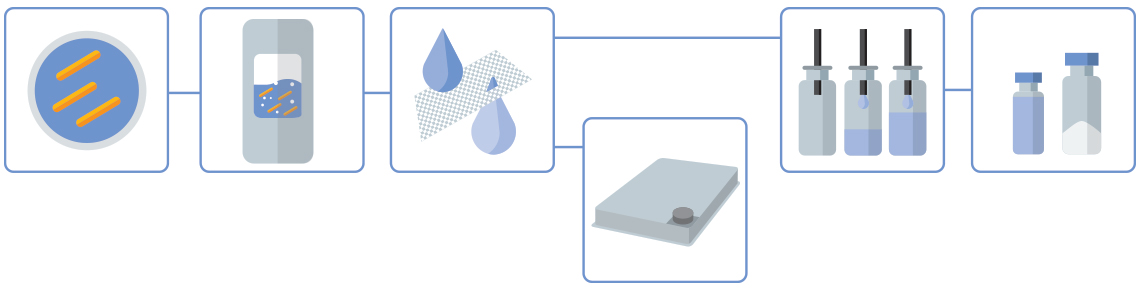
Die Stämme werden vom Kunden bereitgestellt.
Die Nutzung der von EMA/FDA zugelassenen Produktionslinien von Wacker Biotech (von 250 L Einweg-Bioreaktoren bis zu 1.500 l Edelstahlfermentern) ermöglicht es den Kunden, den Maßstab der GMP-Prozesse flexibel an die Anforderungen jedes Projekts und jeder Entwicklungsphase anzupassen.
Ein vorhandener Zentrifugationsschritt wird in der Regel durch einen Ultra-/Mikrofiltrationsschritt mittels Tangentialflussfiltration (TFF) ersetzt. Auch dies ist eine Einwegtechnologie und stellt sicher, dass der Prozess in allen Phasen geschlossen und monoseptisch bleibt.
Bulk-Wirkstoffe können in Trays abgefüllt und lyophilisiert werden. Bulk-Lyophilisierungen von bis zu 65 L werden unterstützt.
Aseptische Abfüllungen erfolgen in der GMP Fill & Finish-Anlage von Wacker Biotech, die sowohl einen Bereich für Formulierung/Vorbereitung als auch den Hauptabfüllbereich umfasst.
Arzneimittel können in Vials abgefüllt werden. Chargenabfüllungen sind für bis zu 20.000 Einheiten (DIN 2R bis 20R) sowohl für flüssige als auch für lyophilisierte Formulierungen möglich.
Die Aurealis Therapeutics AG wandte sich an Wacker Biotech für die Prozessentwicklung, Hochskalierung und GMP-Herstellung von AUP1602-C, ihrem führenden Wirkstoffkandidaten für die Behandlung chronischer Wunden. Genetisch veränderte Laktobakterien werden topisch appliziert, um die Geweberegeneration bei Patienten mit nicht heilenden chronischen Wunden zu fördern. Die Herstellung unter monoseptischen Bedingungen war erforderlich, da das Produkt in direktem Kontakt mit menschlichem Gewebe steht.
Der Prozess wurde erfolgreich übertragen, an die monoseptische Herstellung unter GMP-Bedingungen angepasst und hochskaliert. Die anschließende Herstellung erfolgte unter monoseptischen GMP-Bedingungen unter Verwendung des 250 l Einweg-Bioreaktors von Wacker Biotech, gefolgt von der aseptischen Abfüllung in ca. 4.000 Vials pro Charge. Der entwickelte Prozess erwies sich als hochrobust und lieferte Zellen, die gegenüber Verarbeitung, Wartezeiten und Lagerung bei niedrigen Temperaturen widerstandsfähig sind. Die Zellvitalität des resultierenden Arzneimittels erfüllte die definierten Kriterien (10¹⁰ – 10¹¹ koloniebildende Einheiten/mL). Wacker Biotech führte zudem die Einrichtung, Entwicklung und Validierung der erforderlichen analytischen Assays für Produkttests durch. Das Arzneimittel wurde erfolgreich für den Einsatz in Phase-I-Studien freigegeben, und eine Phase-II-Studie ist nun geplant.
„Wir sind sehr zufrieden mit der hohen technischen Kompetenz, Zuverlässigkeit und Unterstützung des Wacker-Teams, das unseren führenden Wirkstoffkandidaten wie geplant in die Klinik gebracht hat – Wacker ist ein echter Partner in diesem Projekt.“
Juha Yrjänheikki, CEO von Aurealis TherapeuticsFür das in London ansässige Unternehmen Prokarium, einen Pionier auf dem Gebiet der mikrobiellen Immuntherapie, führt Wacker Biotech die GMP-konforme Herstellung eines oralen Biopharmazeutikums gegen Blasenkrebs durch. Die Pipeline von Prokarium nutzt die neuesten Fortschritte in der Krebsimmunologie, um die Immunonkologie auf die nächste Stufe zu heben. Insbesondere werden genetisch veränderte Salmonellen als Liefermechanismus eingesetzt, um anti-tumorale Wirkstoffe gezielt in Blasenzellen zu transportieren.
Wir freuen uns sehr über die Zusammenarbeit mit Wacker Biotech, da sie über umfassende Expertise in der Herstellung lebender mikrobieller Produkte und GMP-Produktion verfügen.“
Kristen Albright, PharmD, CEO von Prokarium
Entdecken Sie, wie Wacker Biotech Ihre biopharmazeutische Produktion verändern kann. Kontaktieren Sie uns noch heute, um mehr über unsere innovativen Lösungen zu erfahren und zu erfahren, wie wir Ihnen helfen können, Ihre Ziele zu erreichen. Wenden Sie sich an unser Team, um weitere Informationen zu erhalten.
KontaktWir freuen uns darauf, Ihre Biologika zum Leben zu erwecken.