01.03.2018 Lesezeit: ca. MinutenMinute
Schlüsselkomponente Lithium-Ionen-Batterie
Als Lithium-Ionen-Batterien werden wiederaufladbare Batteriesysteme bezeichnet, deren Zellen Lithiumionen als bewegliche positive Ladungsträger nutzen. Die Zellen enthalten zwei Elektroden, die Lithiumionen reversibel einlagern können, und einen Elektrolyten, in dem die Lithiumionen zwischen den Elektroden transportiert werden. Zusätzlich befindet sich zwischen den Elektroden eine dünne, als Separator bezeichnete Membran, die elektrisch isolierend wirkt, aber für Lithiumionen durchlässig ist. In den beiden Elektrodenmaterialien finden – räumlich voneinander getrennt – chemische Reaktionen statt, durch die eine elektrische Spannung zwischen den Elektroden entsteht.
Für die Fertigung von Antriebsbatterien werden gegenwärtig häufig Zellen mit Graphit-Anoden und Kathoden aus einem Lithium-Nickel-Mangan-Cobalt-Oxid (kurz: NMC) verwendet. Die Elektrodenmaterialien befinden sich als dünne Schicht auf Metallfolien, die als Ableiter fungieren und ab- oder zufließende Elektronen weiterleiten. Als Elektrolyt dient die Lösung eines lithiumionenhaltigen Leitsalzes (Lithiumhexafluorophosphat) in einer Mischung aus organischen Carbonaten.

Mehr zum Thema Elektromobilität lesen Sie in unserem Artikel "Vorsprung durch Volt"
Solche NMC-Graphit-Batteriezellen erreichen sowohl eine hohe spezifische Energie als auch eine hohe Leistungsdichte, können also große Energiemengen pro Kilogramm speichern und die gespeicherte Energie auch schnell wieder abgeben. Technisch machbar, wenn auch noch nicht allgemein verbreitet in der Industrie, sind bei den Batteriezellen spezifische Energien von bis zu 260 Wattstunden pro Kilogramm.
Wird ein elektrischer Verbraucher an die geladene Zelle angeschlossen, gibt die Anode Elektronen an ihren Ableiter ab und setzt eingelagerte Lithiumionen frei. Die Elektronen fließen durch den externen Verbraucherstromkreis, verrichten dort Arbeit und fließen weiter zur Kathode, welche die Elektronen über ihren Ableiter aufnimmt. Währenddessen wandern die aus dem Graphitmaterial der Anode freigesetzten Lithiumionen durch den Elektrolyten zur Kathode und lagern sich dort ein. Beim Laden der Batterie kehrt sich der gesamte Vorgang um.
Beim allerersten Laden, das im Rahmen der Batterieherstellung erfolgt, zersetzt sich eine gewisse Menge des Elektrolyten an der Anodenoberfläche. Die lithiumhaltigen Zersetzungsprodukte bilden auf der Anode einen festen, für Lithiumionen durchlässigen Film. Dieser kurz als SEI (solid electrolyte interphase) bezeichnete Oberflächenfilm schützt den Elektrolyten vor weiterer Zersetzung. Verschiedene Belastungen der Batteriezelle, wie Tiefentladung oder auch hohe Temperaturen, können Teile des SEI schädigen. Zwar wird dann beim nächsten Laden wieder SEI nachgebildet, da hierbei aber Lithiumionen irreversibel aus dem Elektrolyten entfernt werden, ist ein Kapazitätsverlust der Batterie die Folge: Sie kann dann nicht mehr so große Ladungsmengen speichern wie vorher.
Schädlich ist auch ein Überladen der Batterie. Dabei können so viele Lithiumionen aus dem Kathodenmaterial austreten, dass dessen Struktur Schaden nimmt. Zudem besteht die Gefahr, dass sich auf der Anode metallisches Lithium in Form spitzer, verzweigter Kristalle, sogenannter Dendriten, abscheidet. Diese elektrisch leitfähigen Lithiumdendriten können den Separator durchstechen und dadurch einen inneren Kurzschluss auslösen.

In einer typischen Antriebsbatterie kommen zahlreiche Siliconkautschuk-Produkte (blau dargestellt) zum Einsatz.
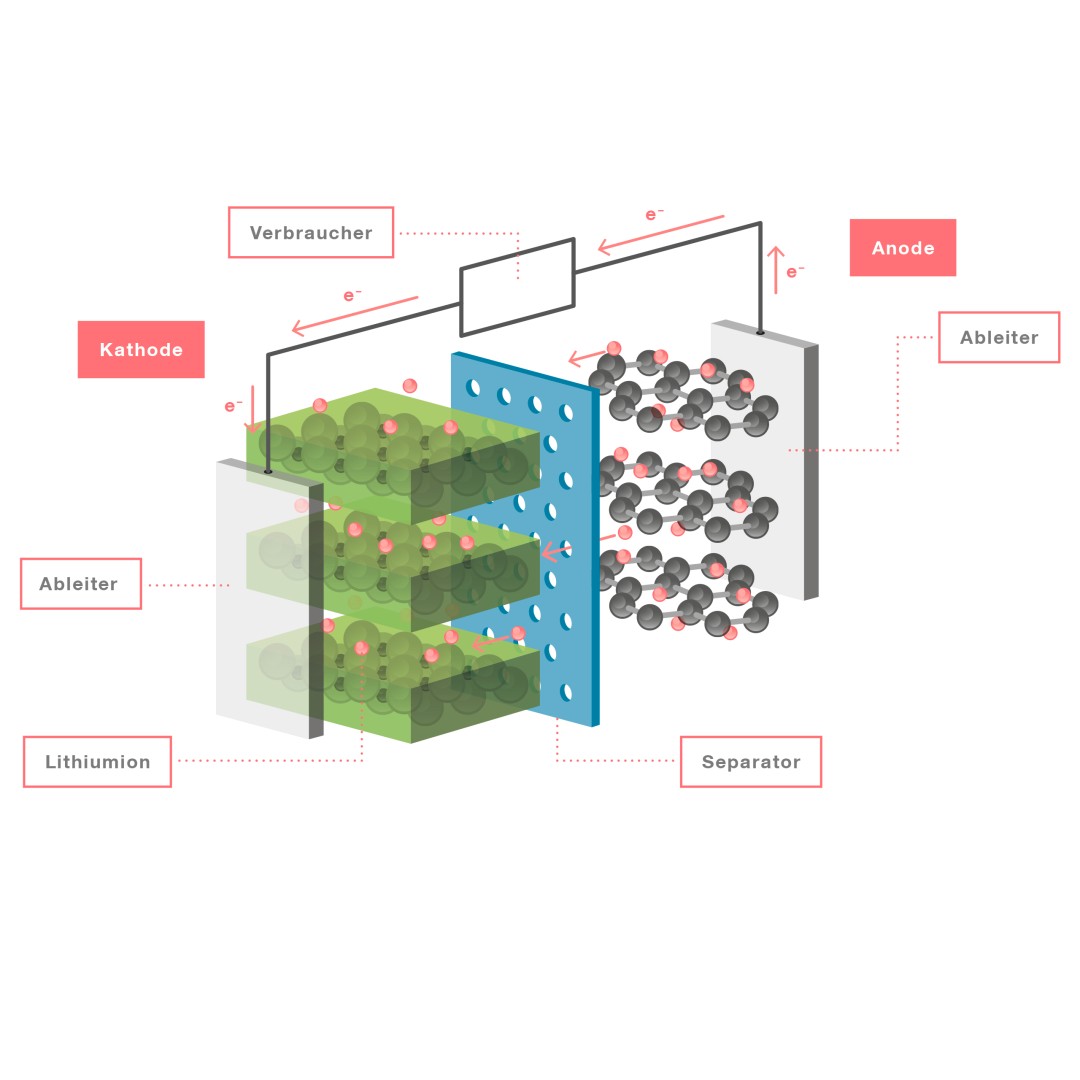
Aufbau und Funktionsprinzip einer Lithium-Ionen-Batteriezelle: Bei der Entladung der Zelle setzt das Anodenmaterial eingelagerte Lithiumionen frei und gibt Elektronen (e–) an den Ableiter ab. Die freigesetzten Lithiumionen bewegen sich im Elektrolyten zur Kathode, durchdringen den Separator und werden in das Kathodenmaterial eingelagert. Die Anode bildet den Minuspol, die Kathode den Pluspol der Zelle.
Batterien müssen temperiert werden
Je kälter die Batterie ist, desto zähflüssiger wird der Elektrolyt und desto stärker wird die Wanderung der Lithiumionen behindert. Bei tiefen Temperaturen besteht beim Laden die Gefahr, dass aufgrund auftretender Überpotenziale das Lithium in metallischer Form abgeschieden wird, anstatt in den Graphit eingelagert zu werden.
Hohe Temperaturen beschleunigen chemische Reaktionen. In der Lithium-Ionen-Batterie macht sich das besonders stark bei den unerwünschten Alterungs- und Abbauvorgängen bemerkbar. Schon Temperaturen von über 45 Grad Celsius lassen eine Lithium-Ionen-Batterie rapide altern, bei 60 Grad stößt das Leitsalz an die Grenze seiner thermischen Beständigkeit. Das Temperaturoptimum liegt bei 25 Grad Celsius.
Die Batterie muss also temperiert werden – sie darf im Betrieb nicht zu kalt und nicht zu warm werden. In der Praxis wird die Antriebsbatterie auf Betriebstemperaturen zwischen 0 und 45 Grad Celsius gehalten. Die neu entwickelten Silicon-Gap-Filler von WACKER unterstützen den Wärmetransport zwischen den Batteriemodulen und dem Temperierungssystem, etwa der in der Gehäuse-Unterschale liegenden, von einem Kühlmittel durchströmten Kühlplatte.
Kontakt
Mehr Informationen zum Thema erhalten Sie von
Herr Dr. Klaus Angermaier
Global Business Development
WACKER SILICONES
+49 89 6279-1453
Nachricht senden
